2. مواد و روشهای تحقیق بر روی اثرات کاشت ایمپلنت
شکل 1 ماکروهندسه ایمپلنت ها و جزئیات قطر و پیچ آنها. (a) نمونه ای از گروه ایمپلنت strong با دندانه کوچک تر / مثلثی V شکل (اندازه: 3.75 میلی متر × 13 میلی متر). (ب) نمونه ای از ایمپلنت stylus با زاویه های داخلی دندانه کوچکتر / دندانه مربعی (اندازه: 4.0 میلی متر × 13 میلی متر). (c) نمونه ای از ایمپلنت Tryon با زاویه های داخلی کوچکتر دندانه / دندانه مربعی (اندازه: 3.75 میلی متر × 13 میلی متر)؛
همه نمونه های با سطح پرداخت (treatment) یکسان به طور مستقیم از تولید کننده خریداری شدند. این پرداخت شامل پردخت با اسید نیتریک و سپس اسید سولفوریک (DAA، اچینگ مضاعف با اسید)، با توجه به توضیحات سازنده است.
.2.2. قرار دادن ایمپلنت در دنده خوک
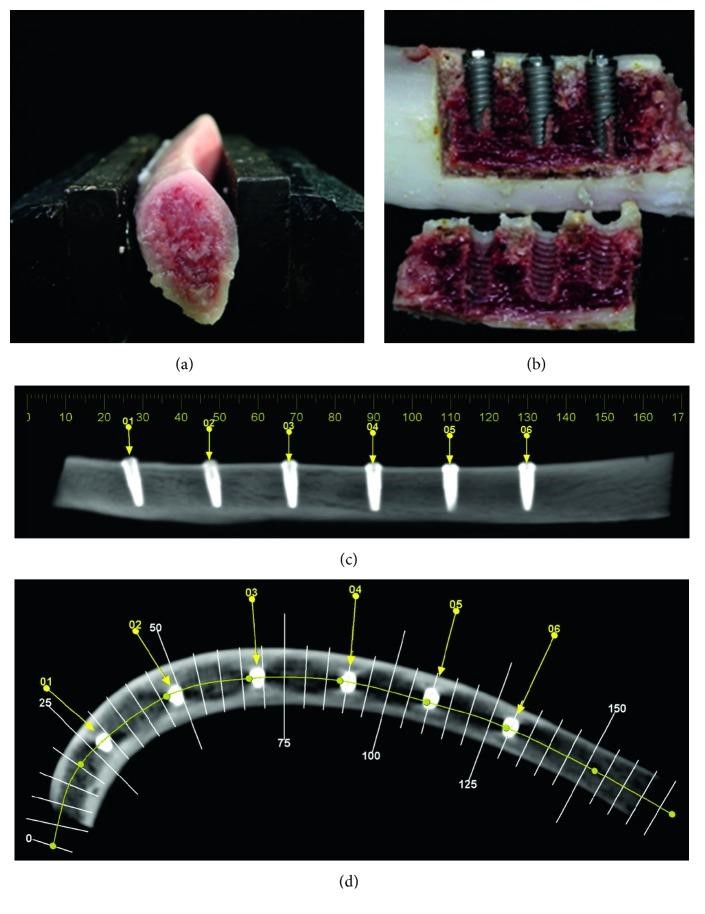
نه دنده تازه خوک (کیفیت استخوانی D3) با 15 میلیمتر بلندی و طول 15 سانتیمتر به عنوان یک مدل تجربی استفاده شد. سه ایمپلنت با ماکروهندسه مختلف در سه دنده خوک برای تحلیل سطوح ایمپلنت (n = 9) و شش ایمپلنت با ماکروهندسه مختلف (18 = n) در سه دنده خوک برای تجزیه و تحلیل سلولی قرار داده شد. با توجه به اینکه حیوانات برای اهداف تحقیقی قربانی نشدند، این مطالعه از تصویب کمیته اخلاق حیوانی معاف بود. ایمپلنت های دندانی در سوراخهای عمیق 13 میلی متری قرار گرفتند، ( دستورالعمل سازنده ، شکل 2 (a) و 2 (ب))، توسط یک جراح متخصص و سوراخ نهایی با ابعاد 3.0 میلیمتر با استفاده از دریل ایجاد شد.
فاصله بین ایمپلنت ها 20 میلی متر بود. ثابت شدن ایمپلنت با استفاده از یک آچار ترک دستی اندازه گیری شد، با حداکثر گشتاور 60 N cm ، همانطور که توسط سازنده توصیه می شود. سی تی اسکن برای تعیین محل دقیق هر ایمپلنت (شکل 2 (c) و 2 (d)) انجام شد. پس از نصب، ایمپلنت ها با استفاده از نوک آلتراسونیک پیزوالکتریک (PiezoSurgery® White، Mectron، Italy) خارج شده و استخوان به سمت ایمپلنت برش داده شد و مراقبت شد تا به سطح ایمپلنت آسیب نزنند و اجازه دهند تا ایمپلنت ها از استخوان آزاد شوند.
مطالب مرتبط: قیمت ایمپلنت دندان
شکل 2 (a) دنده خوک برای نصب ایمپلنتها. (ب) دنده خوک عمودی با ایمپلنت های strong پس از استئوتومی با آلتراسونیک پیزوالکتریک. (c، d) ، CT عرضی ایمپلنت به دنده خوک.
حذف باقیمانده استخوانی از سطح ایمپلنتها با غوطه وری در آب فیلتر شده (30 دقیقه) و سپس در استون (10 دقیقه) انجام شد .
2.3. مشخصه های سطوح ایمپلنت
میکروسکوپ الکترونی روبشی (SEM) و تداخل سنجی لیزر و برای تعیین مشخصه های سطوح ایمپلنت استفاده شد. برای بررسی توپوگرافی سطح ، تداخل سنج لیزری سه بعدی با تراکم 1000 × 1000 نقطه و نرخ اندازه گیری 300 نقطه در ثانیه با استفاده از روش پیوسته، مورد استفاده قرار گرفت. منطقه اندازه گیری 0.8 × 0.4 میلی متر بود که اجازه می دهد تا حداقل یک دندانه برای همه مناطق بدون از دست رفتن تمرکز بررسی شود.
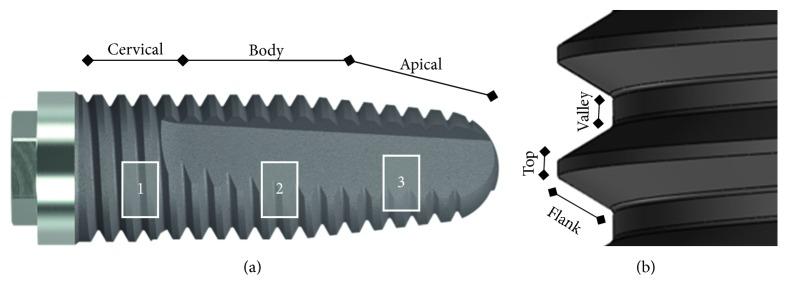
به علت پیچیدگی ماکرو هندسه ایمپلنت ها، مناطق مختلف برای هر ایمپلنت اندازه گیری شد، همانطور که در شکل 3 نشان داده شده است. همه نمونه ها مورد ارزیابی قرار گرفتند (n = 18)، 9 تا قبل از نصب، و 9 تا بعد از آن، 6 مورد از مدل Strong ، 6 تا Stylus و 6 تا Tryon اندازه گیری شد.
هر ایمپلنت برای تجزیه و تحلیل به سه منطقه تقسیم شد: 4 میلیمتر در ناحیه طوق دندان ، 5 میلیمتر در داخل بدنه ایمپلنت و 4 میلیمتر در انتهای اپیکال (شکل 3 (a)). بنابراین، برای هر منطقه سه ناحیه بالا، ته و پهلو (شکل 3 (b) مورد بررسی و اندازه گیری قرار گرفتند، مجموعا 27 اندازه گیری برای هر ایمپلنت در هر منطقه. تمام ایمپلنتها به طور تصادفی برای به حداقل رساندن اثرات سوگیری مورد بررسی قرار گرفتند.
مطالب مرتبط: ایمپلنت فوری
شکل 3 (a) مناطق تجزیه و تحلیل شده ایمپلنت: 1-گردن ، 2-بدنه و 3-آپیکال. (b) مناطق مورد تجزیه و تحلیل هر دندانه (بالا، پهلو و ته) مناطق 1، 2، و 3.
ویژگی توپوگرافی سطح شامل سه جزء است: شکل، موج دار بودن و زبری، که فیلترهایی برای جداسازی هر یک از این اجزاء لازم است. برای این منظور ، نرم افزار Map Mountains مورد استفاده قرار گرفت که همچنین اجازه می دهد تا تصاویر دو بعدی و سه بعدی بر اساس توصیف عددی ارامترهای زبری سطح، تهیه شود. برای مشخص کردن شکل ایمپلنت ها (ماکرو هندسه)، پروفایل دندانه ها انتخاب شدند.
ارتفاع و زاویه های عمودی در پروفایل ها اندازه گیری شد. نرم افزار MB Ruler برای محاسبه زوایای دندانه ایمپلنت، طول کل پروفایل دندانه ایمپلنت و طول هر پهلو، ته و پایین استفاده شد. . با تقسیم طول کل به طول مشخص هر منطقه، درصد سطح هر منطقه نسبت به کل سطح ایمپلنت تخمین زده شد. برای محاسبه پارامترهای زبری، اولین قدم استفاده از یک فیلتر برای حذف شکل ایمپلنت بود.
سپس یک فیلتر گوسی 50 * 50 میکرومتر برای جداسازی زبری از موجداری استفاده شد. توصیف عددی زبری سطح در مناطق مختلف با استفاده از سه پارامتر ارتفاع (Sa، Ssk و Sku)، یک پارامتر فضایی (Str) و یک پارامتر ترکیبی (Sdq) انجام شد. همچنین، از Sa به عنوان میانگین زبری اشاره شده است، و متوسط ارتفاع زبری است.
Ssk و Sku مربوط به منحنی توزیع ارتفاع میباشند، در حالیکه Ssk عدم تقارن انحرافات سطح از میانگین سطح می باشد و Sku تیزی توزیع ارتفاع سطح است. Str نسبت ابعاد بافت سطح است که برای شناسایی یکنواختی بافت استفاده می شود. Sdq جذر میانگین مربّعات شیب زبری است. توصیف ریاضی این پارامترها را در مطالعه Stout et al می توان دید. مطالعات دیگر از پارامترهای مشابهی برای توصیف توپوگرافی سطحی ایمپلنت دندان استفاده کرده اند.
تصاویر SEM از بالا، ته و پهلو قبل و بعد از نصب ایمپلنت برای ارائه یک تحلیل کیفیاز سطوح (EVO MA 10، کارل زایس، آلمان) با بزرگنمایی های مختلف و ولتاژ 15 کیلو ولت تهیه شد. این مشخصه سطح در سه ایمپلنت با ماکرو هندسه مختلف قبل از نصب (ایمپلنت B) و در سه ایمپلنت بعد از نصب (ایمپلنت A) انجام شد.
آزمایشات تکثیر و قابلیت زیست سلولی استئوبلاست ، و نیز اندازه گیری استئوپونتین در سطوح مختلف، قبل و بعد از نصب ایمپلنت انجام شد. تمام تست ها با سه تکرار با تراکم 1.9×104 انجام شد. برای ارزیابی تکثیر سلولی از روش trypan blue vital exclusion ، در 24 ساعت، 48 ساعت و 96 ساعت از کشت سلول ها بر روی سطوح، استفاده شد. سلول ها به روش آنزیمی از سطوح با محلول تریپسین 0.25 درصد (Gibco)، و EDTA 1 میلی مولار جدا شدند. و سپس سلول ها با استفاده از هموسیتومتر شمارش شدند (Hausser Scientific، Horsham، PA). تکثیر سلول به صورت تعداد سلول ها × 104 بیان شد.
میزان زنده بودن سلول ها با استفاده از سنجش 3-[4,5-dimethylthiazol-2-yl]-2,5-diphenyl tetrazolium bromide بعد از 24، 48 و 72 ساعت اندازه گیری شد. به طور خلاصه، سلول ها با 10٪ MTT ( 5 میلی گرم بر میلی لیتر) در محیط کشت در دمای 37 درجه سانتی گراد به مدت 4 ساعت کشت شدند. سپس محلول MTT از چاه دمیده شده و 200 میکرولیتر دی متیل سولفوکسید به هر چاه اضافه شد.
سپس، صفحات 5 دقیقه روی صفحه تکاننده قرار گرفتند و 150 میکرولیتر از این محلول به یک صفحه 96 - چاه جدید انتقال یافت. چگالی نوری در 570-650 نانومتر از روی صفحه (Epoch ؛ Bio-Tek، Winooski، VT) خوانده شد و مقدار جذب ، تعیین شد. تعیین استئپونتین ترشح شده توسط سلول های استئوبلاست کشت شده روی سطوح مختلف توسط ایمنی سنجی آنزیم (ELISA) انجام شد.
ماده شناور جمع آوری شد و به مدت 10 دقیقه در g 336 سانتریفیوژ گردید و دوباره ماده شناور جمع آوری شد ، و در دمای -80 درجه سانتیگراد ذخیره شد. اندازه گیری osteopontin با استفاده از Mouse Osteopontin kit (R & D Systems، Minneapolis، USA) بر اساس دستورالعمل های تولید کننده انجام شد. مقادیر به صورت ng / ml. بیان شد.
4.2 تجزیه و تحلیل آماری برای هر پارامتر، میانگین و مقادیر انحراف معیار برای ایمپلنت قبل و بعد از نصب محاسبه شد. به منظور ارزیابی اهمیت آماری، پارامترهای توپوگرافی (B و A) با استفاده از آزمون t زوجی (α = 0.05) (SPSS Statistics Base 17.0-IBM، شیکاگو، آمریکا) مورد تجزیه و تحلیل قرار گرفتند. آزمون شاپیرو ویلک برای آزمون نرمال بودن روی داده های جمع آوری شده انجام شد ، که نرمال بودن تایید نشد. آزمون ویلکاکسون برای مقایسه بهتر بین دو نمونه از لحاظ آماری مشابه، بر روی نمونه های وابسته استفاده شده است. جنبه های مورفولوژیکی قبل از (B) و پس از (A) نصب ایمپلنت در استخوان برای Strong، Stylus و Tryon مقایسه شد. کل مطالعه با توجه به سطح اطمینان 95٪ انجام شد. مقایسه ایمپلنت های با ماکروهندسه مختلف انجام نشد، زیرا منطقه رسوب سلولی در پهلو و ته، در میان گروه ها متفاوت بود.
3. نتایج و بحث درباره اثرات ایمپلنت دندانی بر روی فک
3 .1. مشخصه سطح گشتاور ورودی ایمپلنت از حداکثر مقادیر توصیه شده توسط سازنده تجاوز نمی کند و گشتاور ورودی در میان سه ایمپلنت قابل ملاحظه ای است، که احتمالا به علت تاثیر ماکروهندسه بر روی استخوان دنده خوک،( D3 )است. میانگین گشتاور ورودی، 48.3 3(±10.98) N.cm)) برای Strong، 33،88 (± 15،58 برای Stylus و 33.05 (± 13.84) برای Tryon بود. دنده خوک به علت ضخامت (2 میلیمتر ضخامت) و ساختار استخوانی میکروسکوپی که شبیه استخوان انسانی است، انتخاب شده است. جدول 1 مقادیر پارامترهای مورد استفاده برای توصیف دندانه ها در مناطق مختلف برای هر یک از ایمپلنت ها را نشان می دهد. تغییراتی در زاویه و ارتفاع بین مناطق برای یک ایمپلنت مشاهده شد. ایمپلنت Strong با با ارتفاع دندانه کمتری ارائه شده است، در حالی که ایمپلنت Stylus دارای زاویه های دندانه داخلی پایین تر است. پهلو های دندانه برای همه ایمپلنتها متناظر با منطقه بزرگتر بود. بالای دندانه ها ، دومین مناطق در ایمپلنت های Stylus و Tryon از نظر سطح بودند، در حالی که ته دندانه ها دومین مناطق در ایمپلنت Strong بود. جدول 1 : اندازه گیری های ماکروهندسی ایمپلنت ها ، α1 و α2 زاویه داخلی بین پهلو ها و h ، ارتفاع دندانه است. (ایمپلنت و حفظ استخوان فک در دوران سالمندی)
|
ایمپلنت |
گشتاور وارد کردن (میانگین ± SD) |
منطقه |
α 1(درجه) |
α 2(درجه) |
ارتفاع, h (µm) |
درصد سطح نسبت به طول کل ایمپلنت |
|
Strong |
48.33 N cm ± 10.98 |
منطقه 1-cervical |
59.3 |
59.9 |
331.6 |
Top: 10.25% |
|
منطقه 2-body |
59.7 |
61.7 |
349.5 |
Flank: 63.03% |
||
|
Region 3-apical |
59.7 |
59.2 |
250.1 |
Valley: 26.70% |
||
|
Mean |
59.9 |
310.4 |
|
|||
|
Stylus |
33.88 N cm ±15.58 |
Region 1-cervical |
58.7 |
62.1 |
389.4 |
Top: 15.14% |
|
Region 2-body |
59.6 |
57.1 |
380.0 |
Flank: 75.35% |
||
|
Region 3-apical |
50.7 |
59.2 |
283.6 |
Valley: 9.49% |
||
|
Mean |
57.9 |
351.0 |
|
|||
|
Tryon |
33.05 N cm ±13.84 |
Region 1-cervical |
55.8 |
55.6 |
350.1 |
Top: 17.11% |
|
Region 2-body |
55.9 |
59.7 |
362.1 |
Flank: 73.72% |
||
|
Region 3-apical |
63.2 |
58.1 |
312.5 |
Valley: 9.79% |
||
|
Mean |
58.0 |
341.6 |
|
|||
مقادیر میانگین ± انحراف معیار پارامترهای زبری سطح (Sa، Ssk، Sku، Str و Sdq) ، میانگین های تمام مناطق 1، 2 و 3 برای هر نوع ایمپلنت دندانی (B و A) بوده و در جدول 2 نشان داده شده است. مقادیر کل Δ، تفاوت بین میانگین تمام مناطق (بالا، پهلو و ته) قبل و بعد از قرار دادن ایمپلنت برای هر نوع ایمپلنت است که در جدول 2 نشان داده شده است.
با توجه به روش های ارزیابی، مطالعات دیگر نیز برای ارزیابی تغییرات سطح از میکروسکوپ الکترونی روبشی و تداخل سنجی لیزری استفاده کرده اند. تداخل سنجی لیزری به عنوان یک روش سنجش عالی برای بررسی توپوگرافی ایمپلنت پیشنهاد شده است، . پارامترهای زبری سطح (3D) قبل و بعد از نصب در دنده خوک مورد بررسی قرار گرفتند. جدول 2 پارامترهای زبری سطح (Sa، Ssk، Sku، Str و Sdq) در سه ناحیه مختلف (بالا، فلان و دره) در ایمپلنت های پیچی قبل (B) و بعد از (A) قرار دادن ایمپلنت در در استخوان که با استفاده از تداخل سنجی لیزر اندازه گیری شده.
|
ایمپلنت |
قبل (B) بعد (A) |
بالا |
پهلو |
ته |
Δ کل (B-A) |
|
S a µm |
|
||||
|
Strong |
B |
0.21 ± 0.02 |
0.69 ± 0.11 |
0.57 ± 0.24 |
0.02 |
|
A |
0.55 ± 1.21 |
0.75 ± 0.31 |
1.35 ± 1.55∗ |
|
|
|
Stylus |
B |
0.23 ± 0.03 |
0.70 ± 0.10 |
0.26 ± 0.13 |
0.42 |
|
A |
0.16 ± 0.11∗ |
0.99 ± 1.04 |
2.38 ± 3.85 |
|
|
|
Tryon |
B |
0.48 ± 0.26 |
1.98 ± 0.68 |
0.10 ± 0.07 |
0.17 |
|
A |
0.47 ± 0.64 |
1.25 ± 0.46∗ |
3.68 ± 2.46∗ |
|
|
|
S sk |
|
||||
|
Strong |
B |
−0.34 ± 0.31 |
0.06 ± 0.37 |
−0.12 ± 0.27 |
−0.01 |
|
A |
−0.20 ± 0.39 |
0.01 ± 0.31 |
−0.14 ± 0.38 |
|
|
|
Stylus |
B |
−0.17 ± 0.19 |
0.07 ± 0.51 |
−0.13 ± 0.52 |
0.01 |
|
A |
−0.17 ± 0.20 |
0.06 ± 0.61 |
−0.63 ± 1.48 |
|
|
|
Tryon |
B |
−0.12 ± 0.45 |
0.06 ± 0.57 |
−0.02 ± 0.32 |
−0.02 |
|
A |
−0.11 ± 0.61 |
0.19 ± 0.63 |
0.17 ± 0.82 |
|
|
|
S ku |
|
||||
|
Strong |
B |
4.21 ± 1.45 |
3.23 ± 0.81 |
3.58 ± 0.49 |
−0.04 |
|
A |
13.54 ± 4.88 |
3.50 ± 0.73 |
3.40 ± 0.99 |
|
|
|
Stylus |
B |
3.63 ± 0.50 |
3.36 ± 4.60 |
3.52 ± 1.06 |
−0.02 |
|
A |
6.99 ± 4.36∗ |
9.54 ± 6.68∗ |
17.64 ± 33.52∗ |
|
|
|
Tryon |
B |
4.60 ± 1.75 |
3.69 ± 1.78 |
3.01 ± 0.56 |
−0.05 |
|
A |
8.48 ± 7.18∗ |
4.72 ± 3.21 |
4.92 ± 5.89 |
|
|
|
S tr µm |
|
||||
|
Strong |
B |
0.21 ± 0.05 |
0.10 ± 0,13 |
0.17 ± 0.07 |
0.01 |
|
A |
0.22 ± 0.14 |
0.05 ± 0,06 |
0.19 ± 0.18 |
|
|
|
Stylus |
B |
0.21 ± 0.05 |
0.08 ± 0.01 |
0.09 ± 0.03 |
0.01 |
|
A |
0.21 ± 0.11 |
0.03 ± 0.02∗ |
0.03 ± 0.02∗ |
|
|
|
Tryon |
B |
0.15 ± 0.10 |
0.11 ± 0.11 |
0.08 ± 0.02 |
−0.01 |
|
A |
0.15 ± 0.10 |
0.04 ± 0.01∗ |
0.04 ± 0.02∗ |
|
|
|
S dq µm |
|
||||
|
Strong |
B |
0.03 ± 0.03 |
1.12 ± 0.19 |
0.40 ± 0.08 |
−0.05 |
|
A |
0.53 ± 0.34∗ |
1.20 ± 0.58 |
2.07 ± 2.30∗ |
|
|
|
Stylus |
B |
0.42 ± 0.05 |
1.14 ± 1.11 |
5.02 ± 2.27 |
0.53 |
|
A |
0.36 ± 0.11∗ |
1.80 ± 1.66∗ |
4.67 ± 7.14 |
|
|
|
Tryon |
B |
0.85 ± 0.46 |
3.15 ± 1.11 |
1.15 ± 0.40 |
−0.01 |
|
A |
0.88 ± 0.99 |
1.95 ± 0.73∗ |
5.77 ± 4.40∗ |
|
|
برای بالای تاپ ها، بانه ها و دره ها، ماکروهندسه ایمپلنت تاثیر معنی داری در مقادیر Sa ، عمدتا برای ایمپلنت های Strong و Tryon دارند. با توجه به اثرات جای دهی استخوان، مشاهده شد که پارامتر Sa، که نشان دهنده میانگین ارتفاع بی نظمی های سطح است، پس از جای دهی در استخوان برای Stylus ، (Stylus top p = 0.000)، در مناطق بالای دندانه کاهش قابل توجهی نشان می دهد.
لازم به ذکر است که برای این ایمپلنت، مناطق بالا توپوگرافی منظمی را نشان نمی دهد، یعنی، پرداخت سطح به نظر نمی رسد که برای تغییر کل منطقه موثر باشد (شکل 4 (b)). این به نظر می رسید که ناشی از صافی زبری ها در تصاویر SEM باشد که بسیار کمتر از بالای دندانه ایمپلنت Tryon بود. برعکس، برای ایمپلنت Strong ، Sa با با قرار دادن ایمپلنت در استخوان افزایش می یابد ، گرچه انحراف معیار بسیار بالا بود.
مساحت بالای دندانه این ایمپلنت ها نسبت به سایر ایمپلنت ها کمتر بود (جدول 1)، که احتمالا منجر به افزایش فشار تماس در طول فرآیند جای دهی شده. این می تواند منجر به تولید شدید تر باقیمانده های استخوانی شود، که ممکن است مقادیر بالاتر Sa و همچنین پراکندگی بیشتر در نتایج را توجیه کند.
بعضی از شواهد در مورد باقیمانده استخوان با استفاده از فلش در شکل 4 (d) نسبت به بالای دندانه ایمپلنت Strong پس از قرار دادن ایمپلنت نشان داده شده است. کاهش معنی داری در Sa ها بر روی پهلو های دندانه ایمپلنت برای ایمپلنت های Tryon مشاهده شد (p = 0.000). با توجه به ته دندانه ها، تمام مقادیر Sa بعد از قرار دادن ایمپلنت در در استخوان افزایش یافت که در ایمپلنت های Strong (001/0 = P) و Tryon ،( (000/0 = p) قابل توجه بود. این احتمالا با باقیمانده های استخوان های حاصل از جایدهی ایمپلنت در استخوان مرتبط است.
|
زمان |
سلول × 104 میانگین ± SD |
سلول × 104 میانگین ± SD |
|
|
Strong B |
Strong A |
|
24 h |
1.25 ± 0.46 |
1.77 ± 0.45 |
|
48 h |
5.25 ± 0.34 |
4.07 ± 0.26 |
|
96 h |
8.22 ± 0.22 |
8.14 ± 0.56 |
|
|
Stylus B |
Stylus A |
|
24 h |
2.14 ± 0.46 |
1.48 ± 0.25 |
|
48 h |
5.62 ± 0.25 |
4.22 ± 0.22 |
|
96 h |
8.81 ± 0.46 |
9.03 ± 0.26 |
|
|
Tryon B |
Tryon A |
|
24 h |
2.07 ± 0.13 |
1.63 ± 0.34 |
|
48 h |
6.00 ± 0.23 |
3.55 ± 0.22 |
|
96 h |
8.88 ± 0.67 |
9.40 ± 0.34 |
در 24 ساعت، 48 ساعت و 96 ساعت ، اختلاف معنی داری بین قبل و بعد از قرارگیری ایمپلنت در استخوان های خوک (05/0 P>) برای سه نوع ایمپلنت مشاهده نشد. برای آزمایش قابلیت زیستی سلولی، میانگین جذب (± انحراف معیار) در آزمون (در 24 ساعت، 48 ساعت، 96 ساعت) تفاوت معنیداری بین گروههای (B) و (A) برای سه نوع ایمپلنت مشاهده نشد (05 / 0p>). مقادیر در جدول 4 ارائه شده است و p همه آنها در آزمون ویلکاکسون، بیشتر از 0.05 بود.. جدول 4 میانگین (± انحراف معیار) قابلیت زیستی سلول با استفاده از آزمون MTT در استئوبلاست
|
زمان |
چگالی نوری = 590 nm میانگین ± SD |
چگالی نوری = 590 nm میانگین ± SD |
|
|
Strong A |
Strong D |
|
24 h |
0.16 ± 0.00 |
0.11 ± 0.01 |
|
48 h |
0.40 ± 0.03 |
0.30 ± 0.03 |
|
96 h |
0.82 ± 0.02 |
0.73 ± 0.06 |
|
|
Stylus A |
Stylus D |
|
24 h |
0.15 ± 0.01 |
0.12 ± 0.02 |
|
48 h |
0.39 ± 0.03 |
0.29 ± 0.04 |
|
96 h |
1.00 ± 0.00 |
0.58 ± 0.09 |
|
|
Tryon A |
Tryon D |
|
24 h |
0.16 ± 0.02 |
0.11 ± 0.00 |
|
48 h |
0.39 ± 0.01 |
0.30 ± 0.03 |
|
96 h |
0.87 ± 0.01 |
0.73 ± 0.13 |
پرداخت سطحی، ممکن است بر چسبندگی ، مورفولوژی و تکثیر سلولی تاثیر بگذارد و فعالیت سلول های استئوبلاستیک و سازگاری زیستی در پوشش های متخلخل را افزایش دهد، که به نفع پیوند استخوانی است. سطح مورد بررسی در این مطالعه دارای زبری های مختلف در بالا، پهلو و ته دندانه بود. با این وجود، نتایج تکثیر سلولی و قابلیت زیستی سلول ها در هیچ یک از انواع ایمپلنت قبل و بعد از قرارگیری در استخوان در نقاط زمانی ارزیابی شده، تفاوت معنیداری نداشتند .
استئوپونتین یک گلیکوپروتئین فسفریل شده و سولفات شده است که توسط چندین سلول از جمله استئوبلاست ها ترشح می شود، و باعث چسبندگی این سلول ها به ماتریس خارج سلولی می شود.
این یک نشانگر اولیه برای رشد استخوان و تفکیک استئوبلاستیک است، که در ماتریس نابالغ، جبهه های کانی سازی و در استئوبلاست ها بیشتر دیده می شود. بر اساس آزمون ELISA، نتایج حاصل از ترشح استئوپونتیک توسط سلولهای پری استوبلاست روی سطوح مختلف در جدول 5 نشان داده شده است و p همه آنها در آزمون ویلکاکسون، بیشتر از 0.05 بود.جدول 5 میانگین (± انحراف معیار) سنتز استئوپونتین pg / mL بر روی ایمپلنت های B و A اندازه گیری شده از طریق آزمایش ELISA.
|
زمان |
میانگین ± SD |
میانگین ± SD |
|
|
Strong B |
Strong A |
|
24 h |
986.28 ± 81.42 |
1103.2 ± 34.21 |
|
48 h |
156.75 ± 27.99 |
1321.12 ± 117.46 |
|
96 h |
1224.72 ± 161.74 |
1941.33 ± 107.66 |
|
|
Stylus B |
Stylus A |
|
24 h |
1120.01 ± 54.63 |
1222.85 ± 15.38 |
|
48 h |
1891.62 ± 54.72 |
1266.86 ± 104.97 |
|
96 h |
1292.05 ± 59.8 |
1935.2 ± 116.28 |
|
|
Tryon B |
Tryon A |
|
24 h |
964.15 ± 220.98 |
1171.05 ± 96.22 |
|
48 h |
1769.25 ± 146.94 |
1390.77 ± 159.43 |
|
96 h |
1360.34 ± 58.66 |
2078.06 ± 131.64 |
نتایج هیچ تغییری در osteopontin در هر یک از سطوح آزمایش شده (p> 0.05) نشان داد. افزایش اندک استئوپونتیین بعد از 96 ساعت ممکن است برای سه نوع ایمپلنت، پس از نصب در دنده خوک مشاهده شود، اگر چه از نظر آماری معنادار نیست. علیرغم افزایش اندکی در osteopontin در 96 ساعت برای تمام ماکروهندسه ها در ایمپلنت (B) ، در ایمپلنت های (A) در هیچ زمانی، تفاوت ها معنی دار نبود.
چون روش کشت سلول ایمپلنت ها را در موقعیت افقی نگه می داشت، رسوب سلول ها به ته و پهلو های دندانه های پیچ وارد می شد. در این مطالعه، این عامل به عنوان یک محدودیت در نظر گرفته می شود، زیرا ، ارزیابی دقیق رفتار سلول ها در بالا، قله و دره به طور جداگانه ممکن نیست.
به منظور ارزیابی اینکه آیا اصلاح سطح ناشی از وارد شدن به استخوان باعث تغییر رفتار سلول می شود یا نه، این روش ، کارآمد بود. بنابراین، با توجه به محدودیت های این مطالعه، نتایج نشان داد تفاوت معنی داری در رفتار سلول ها قبل و پس از قرار دادن ایمپلنت در استخوان وجود ندارد. در مطالعات آینده، روش کشت سلولی باید برای جلوگیری از رسوب سلول در دندانه های ایمپلنت بهینه سازی شود. امیدواریم از این مطلب کلینیک دندانپزشکی دکتر محمدی راضی بوده باشید.